2. 中国科学院研究生院, 北京 100049;
3. 中法生物矿化与纳米结构联合实验室, 北京 100029
2. Graduate University of Chinese Academy of Sciences, Beijing 100049, China;
3. Franco-Chinese Biomineralization and Nano-structures Laboratory, Beijing 100029, China
纳米级磁铁矿颗粒广泛存在于自然环境中[1].粒径在30nm 以下的超顺磁性(superparamagnetic, SP)磁铁矿颗粒[2],虽然不能像单畴颗粒那样很好地记录天然剩磁,但对沉积物和土壤的磁化率有较大贡献.例如,成土作用中形成的SP磁铁矿和磁赤铁矿可能是黄土-古土壤磁化率增强的重要原因[3].沉积物和土壤中SP 磁铁矿颗粒除了化学成因外,细菌矿化可以生成大量的SP磁铁矿颗粒[4].
铁还原细菌作为生物诱导矿化中的一类重要微生物,它们分布广泛,种类繁多,代谢方式多样,在厌氧条件下能够耦合三价铁的还原和有机物、氢气等电子供体的氧化,从中获得能量以维持细胞生长[5].Fe3+ 被还原成Fe2+ 后能与环境中的其他离子或矿物进一步反应形成次生矿物.其中γ 变形菌纲的Shewanellaputrefaciens和δ 变形菌纲的Geobactermetallireducens[6,7]是研究最为深入的两种典型的铁还原细菌,它们能够还原无定形水合氧化铁矿化形成磁铁矿,从而与环境磁学和元素地球化学循环密切相关.铁还原细菌的生物诱导矿化过程受到诸多因素的制约,如细菌种类、矿化底物、培养基成分、pH 和Eh等,它们都能影响细菌铁还原和矿化过程以及终产物的性质.已有研究表明铁还原细菌在实验室不同条件下能够形成包括菱铁矿、磁铁矿、蓝铁矿等在内的各类矿物[8],其中磁铁矿大多是30nm以下的SP颗粒[9].铁还原细菌诱导矿化的发生首先取决于Fe3+ 的还原,细菌还原铁的方式包括细菌和矿物直接接触,通过电子传递体和分泌促进铁溶解的螯合物[10].AQDS(2,6-anthraquinone disulphonate)是一种腐殖酸(humic acid)类似物,在低浓度(0.1mM)时就能通过加速细菌和矿物之间的电子传递促进铁还原[11].然而,环境因子(如温度)和AQDS对铁还原细菌矿化过程及产物磁学性质影响的研究较少.
已有研究表明Shewannellaputrefaciens在25-35℃范围内生长良好[12],属于典型的中温型细菌.本文报道在不同温度下(20℃,30℃,37℃)培养S.putrefaciens CN32诱导矿化实验,并检验了电子传递体AQDS的影响.通过测定矿化过程中理化参数(Eh, pH 和Fe2+ 浓度)、磁化率、透射电子显微镜观察,以及室温磁滞回线和低温磁学测量,详细研究了温度和AQDS 对 CN32 矿化过程及产物粒度和磁学性质的影响.
2 样品准备和实验分析方法 2.1 样品准备本研究中使用的铁还原细菌Shewannellaputre faciens CN32 购买自ATCC 菌种保藏中心(编号为BAA-1097).单菌落经LB 液体培养基增殖至指数生长后期后在4℃ 下离心收集细胞,用PIPES(1,4-Piperazinebis, sodium salt)缓冲液洗涤菌体三次后制成菌悬液.为确定接种量,将菌悬液经梯度稀释后涂布LB 平板,通过CFU (colony for mationunit)计算出活体细菌密度为109 个/mL.水合氧化铁(hydrous ferric oxide, HFO)制备方法如下:将10mol/L 氢氧化钠溶液加入到氯化铁溶液中并持续搅拌,直至pH=7.00,将溶液离心后用去离子水清洗3次,厌氧条件下分装至血清瓶中,密封后备用,HFO 终浓度为0.2 mol/L.AQDS母液浓度为1mM,经过滤除菌后密封避光保存.
矿化培养基参考Fredrickson在1998年文献中的配方[8],为防止磷酸根与亚铁离子结合生成磷铁矿沉淀,培养基中加入酵母提取物替代磷酸盐作为生长促进剂.
培养基中加入30 mM PIPES作为缓冲液,pH调节到7.20,加入0.1% 刃天青作为氧化还原指示剂.培养基煮沸后通入经高温铜柱除氧的高纯氮气,厌氧条件下分装至120mL 血清瓶中,用丁基胶塞和铝盖密封.HFO、AQDS 和细菌的加入都在COY 厌氧手套箱中进行,全部使用一次性无菌注射器,其中AQDS的终浓度为0.1 mM,HFO 的终浓度为20mM,细菌浓度为108 个/mL.根据实验目的设置了两组实验:(1)HFO+ CN32;(2)HFO+ CN32+AQDS,每组设置三个平行样.两个无菌组HFO 和HFO+AQDS同步进行作为实验对照.血清瓶用锡箔纸包裹后放置于不同温度(20℃,30℃,37℃)的恒温培养箱中避光静置培养.反应76h 后,将血清瓶转移到COY 厌氧手套箱中收集矿化产物,并用除氧去离子水清洗三次,冷冻干燥后进行磁学性质测定.
2.2 实验分析方法本研究通过间隔取样测定矿化过程中理化参数的变化,包括Eh, pH 和Fe2+ 浓度.取样时间点为0、4、8、12、16、20、30、40、58h和76h.每次测定前将血清瓶转入COY 厌氧手套箱中用一次性无菌注射器吸取3 mL,其中Eh 在COY 厌氧手套箱内通过Metrohm842氧化还原铂电极探头(瑞士万通公司生产)测定.pH 在COY 厌氧手套箱外通过Delta320pH 计(瑞士梅特勒公司生产)测定.亚铁离子浓度在UV-2102紫外分光光度仪(美国UNICO 公司生产)上通过测定562nm 处的吸光值对比标准曲线计算得到,具体操作是根据Ferrozine方法[13],用0.5mol/L 盐酸提取30min后用0.22μm 滤膜过滤后加入Ferrozine试剂显色后测定OD562,该方法测得的是体系中的二价铁的总量.
矿化产物的形貌和成分分析在透射电子显微镜JEM2010(日本JEOL 公司生产)上进行.
磁化率在英国Bartington 公司生产的MS2(MS2Probehandle)磁化率仪上测定,每次将血清瓶放置于探头圈中的同一位置进行测定.冷冻干燥后的矿化产物经称重后装入特制胶囊后用于磁学测定,室温磁滞回线在振荡磁强计(型号VSM-3900)上测定,该仪器的磁场控制精度0.05%,灵敏度5×1010 Am2.样品的低温磁学性质在低温磁性测量系统(型号MPMS(X)P-5)上测定,该仪器的控温精度±0.5%,相对灵敏度5.0×1011 Am2.FC/ZFC 曲线分别是将样品置于有场(40 mT)/零场中冷却到10K 后,在40 mT 场中测量样品的磁化强度随温度升高的变化曲线(从10K 升到300K).
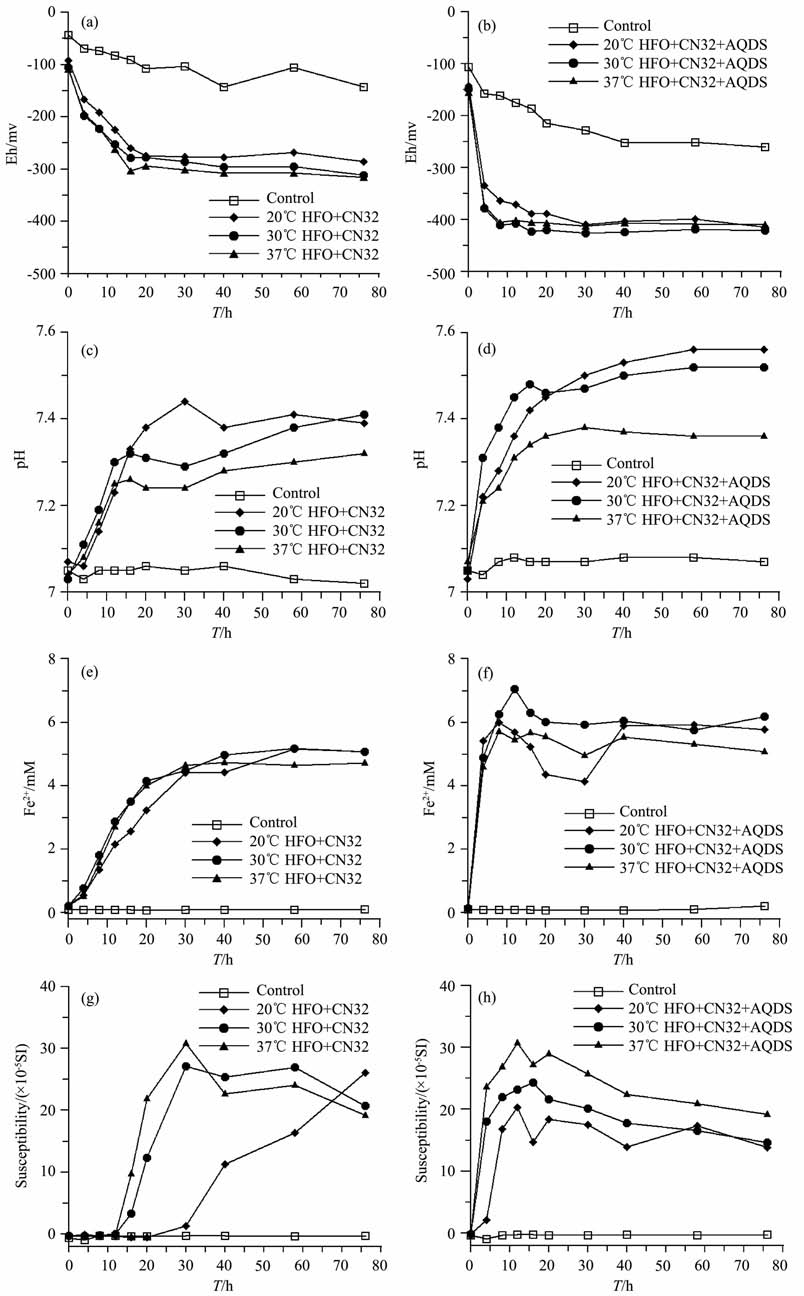
3 实验结果 3.1 CN32矿化过程理化参数变化矿化过程中体系的理化参数变化如图 1所示.加入细菌后,实验组的Eh均快速下降,同时pH 值上升,表明细菌的代谢使反应体系逐渐偏向还原和碱性环境.而对照组仅Eh值略有下降,这可能是培养基部分成分发生氧化还原反应的结果.底物HFO 的颜色变化和产物被磁铁吸引的程度可以用来定性地判断体系的矿化过程.在未加入细菌的两个对照组血清瓶底部的HFO 始终为红棕色,不被磁铁吸引.
|
图 1 培养温度分别为20℃,30℃和37℃下S.putre faciens CN32矿化过程中的Eh, pH,Fe2+ 浓度和磁化率随时间的变化 Fig. 1 Time course analysis ofEh, pH and Fe2+ concentration and Susceptibility duringS. putre faciens CN32 biomineralization at three different temperatures of 20℃,30℃,and 37℃ |
在加入细菌的实验组中都表现出了矿化,HFO由红棕色逐渐变深,并最终转变为黑色.随着反应继续,生成更多的黑色矿物颗粒可被磁铁吸引.从颜色变化、理化参数和磁化率值对比看出,细菌矿化速率与培养温度呈正相关关系,37℃ 时矿化最快,20℃时最慢.在未加入AQDS 的矿化组中,三个培养温度下体系的理化常数变化趋势基本一致,Eh在20h 内均下降到-280 mv 左右,随后趋于稳定.pH 值在前16h内均呈线性上升,在达到7.30后上升速度趋缓,且温度越高,pH 值上升越慢.矿化过程中体系的Fe2+ 浓度也迅速增加,在40h 时达到5mM左右,之后趋于稳定.
加入AQDS的矿化组中,理化参数的变化速率明显加快(较未加入AQDS矿化组).20℃组Eh在8h时就下降到-360mv, 随后缓慢下降到-410mv, 较未加入AQDS 组有明显降低.亚铁离子浓度在4h时就上升到5mM 左右,随后变化趋缓,76h 为5.08 -6.2 mM.20℃、30℃ 和37℃ 各组的pH 在12h时分别为7.36、7.45 和7.31,反应76h 后,37℃组pH 值上升较小,而20℃和30℃组则分别上升到了7.56和7.52.
3.2 透射电子显微镜观察电镜结果显示各矿化组产物颗粒形貌差别不大,产物颗粒聚集成团(图 2a).粒径测量得到产物磁铁矿的平均粒径约为11nm(50个颗粒).能谱分析表明生成矿物的成分主要为铁和氧.高分辨显微照片(图 2c)和选区电子衍射(SAED)显示了磁铁矿的晶面(220),(311),(400),(422),(511)和(440).

|
图 2 30℃下加入AQDS的细菌矿化产物磁铁矿的电镜照片 (a),(b)为聚集程度不同的颗粒;(c)矿物颗粒的高分辨照片;(d)是对颗粒的选区电子衍射(SAED)结果. Fig. 2 TEM image of the magnetite bioproducts for med byS. putre facienas CN32 at 30℃ with AQDS (a) and (b) area gregated particles; (c)is HRTEM of minerals; (d)is the result of SAED of minerals. |
矿化过程中的磁化率变化如图 1(g, h)所示.未加入AQDS 的矿化组中,30℃ 组和37℃ 组在前12h时磁化率基本不变,到16h 时开始上升,30h时达到最大值,随后逐渐下降;20℃ 组磁化率直到30h 才开始上升,到76h 时磁化率增至26.1(×10-5SI).而加入AQDS 的矿化体系中,在反应初始的4h时三个温度矿化组磁化率都出现了显著上升,到12h达到最大值(图 1b).未加入细菌的对照组磁化率一直保持不变.
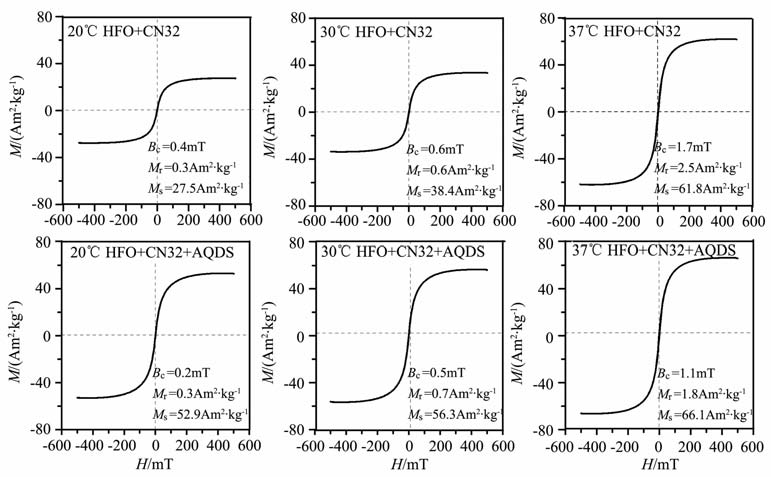
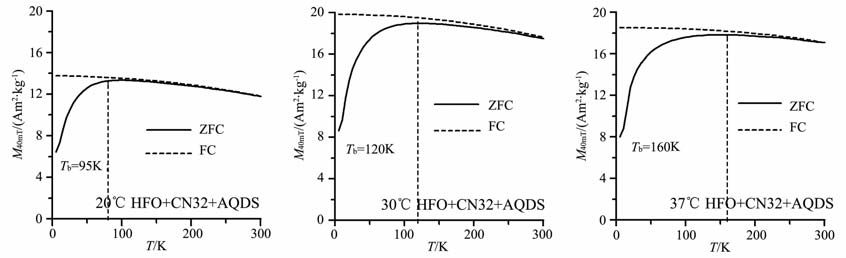
图 3为三个温度条件下各组矿化产物的室温磁滞回线.三个温度条件下,产物磁铁矿的室温磁滞回线均表现出典型的SP 行为,饱和磁化强度Ms随着培养温度的升高而增加,考虑到20℃ 未加入AQDS的实验组矿化仍在继续(图 1g),为了研究矿化终产物的区别,本研究仅测定了加入AQDS的细菌矿化组产物磁铁矿的低温磁学性质,如图 4所示,低场40mT 下的FC 曲线随着温度的升高而降低,ZFC 曲线在升温过程中因逐步解阻而不断升高,到一定程度后由于热能而衰减,ZFC 曲线的峰值温度对应样品的平均解阻温度(Tb),随着矿化体系培养温度的升高,Tb 逐渐增大:20℃ 时的95 K 到30℃时的120K,再到37℃时的160K,暗示产物磁铁矿的平均粒径随着培养温度的上升而增大.
|
图 3 各培养温度下矿化产物的磁滞回线从左至右依次为20℃,30℃,37℃,图中已标注各样品的矫顽力Bc, 剩磁Mr 和饱和磁化强度Ms Fig. 3 Magnetic hysteres is loops of CN32 biomineralization products at different temperatures From left to right:20℃,30℃,37℃ withBc,Mr,Msin the pictures |
磁学和电镜分析结果显示,铁还原细菌S.putrefaciens CN32能够在20-37℃下还原HFO 形成纳米级SP磁铁矿,这和前人对 CN32矿化的研究是一致的[8].较大颗粒的磁铁矿仅在少数嗜热菌的矿化和一些特定培养条件下形成[14,15].在铁还原细菌诱导矿化形成磁铁矿的过程中,矿物的形成主要是三价铁被还原成亚铁离子后与底物HFO 发生无机化学反应的结果.细菌在厌氧条件下还原三价铁,并通过代谢活动改变微环境理化性质,从而间接诱导矿物形成.S. putre faciens CN32是兼性厌氧细菌,在培养初期通过好氧生长消耗培养基中的残余氧,降低了体系的Eh.当生长体系转变为厌氧后细菌通过还原HFO获得能量维持生长,代谢过程改变了反应体系的pH 和Eh, 使得微环境有利于磁铁矿的形成[16].
|
图 4 各培养温度下含AQDS的矿化组磁铁矿的FC/ZFC 曲线其中ZFC在升温过程中的峰值对应样品的平均解阻温度Tb. Fig. 4 The FC/ZFC curves of magnetite with AQDS at different temperatures The peak value in ZFC curve corresponds to theTb of biomineralization products |
未加入AQDS的细菌矿化组中,温度的升高对Eh和铁还原速率没有明显影响,但是对矿化产物的磁化率影响极大.30℃组和37℃ 组在12h 后磁化率呈快速上升,表明开始形成磁铁矿;而20℃ 组磁化率的上升则滞后大约8h.在Eh, pH,亚铁离子浓度等理化参数相似的情况下,温度是影响铁还原细菌诱导矿化体系中磁铁矿形成的关键因素:一方面在热力学上,温度越高越有利于矿物的形成;另一方面,温度的适度提高,加快了细菌的代谢,细胞数量快速增长同时产生大量的代谢物,这些具有高吸附性的生物活性物质,有助于铁离子的富集和晶体的成核.比较而言,加入AQDS 的矿化体系,理化参数变化速率明显加快,更加有利于矿化作用的发生.本研究还进行了低温(4℃)和高温(50℃)下的实验(数据未给出),由于生长温度超出S.putrefaciens CN32的生长适宜范围,4℃下的细菌活性低,因此矿化速率很慢,而50℃下细菌因为不能耐高温而迅速衰亡,矿化过程因此中断.
最近,对一株分离自海洋的耐冷型铁还原细菌S.piezotolerans WP3[17]进行的矿化研究(Wu等稿件审理中)结果显示, WP3 细菌能在其最佳生长温度20℃下快速还原HFO 形成磁铁矿.考虑到接种量的差异( WP3矿化实验中细菌浓度约为 CN32实验中的10%),相比 WP3而言,S.putrefaciens CN32在相同温度下的还原三价铁和矿化速率要慢.不同细菌在同一温度下不同的矿化行为,可能暗示了细菌诱导矿化的菌种特异性.鉴于培养温度的小幅升高即可对矿化产物磁铁矿的磁学性质产生显著影响,可以通过改变培养温度来改造产物磁铁矿的相关性质.与通常在高温下化学合成磁铁矿相比,微生物在常温下即能够快速还原HFO 形成大量SP磁铁矿,这在规模化生产磁性纳米材料上有较大的应用前景.
腐殖酸在自然环境特别是土壤和沉积物中普遍存在,前人的研究表明作为电子传递体的腐殖酸类化合物(AQDS)能够明显加快细菌和矿物之间的电子传递,促进铁还原和细菌代谢[11,18].实验结果显示,AQDS 能明显加快 CN32 的矿化速率.加入AQDS的矿化组的Eh, pH 在0-4h 内即显著变化,而且体系比未加AQDS的实验体系更加偏向还原和碱性环境.磁化率也从4h 时开始快速上升,12h时达到最高值,相比未加入AQDS 组提前了12-18h.已有研究表明,诱导矿化中磁铁矿的形成和亚铁离子供应速率密切相关[19].本实验表明,AQDS加速了S.putrefaciens CN32 铁还原,使得体系的理化环境在热力学上更有利于磁铁矿形成.在较快的亚铁离子供给情况下,磁铁矿迅速形成.
磁化率测定是一个可以有效监测磁铁矿矿化过程的方法.磁化率不仅取决于磁性矿物的种类和含量,也和矿物颗粒的粒度密切相关[20].本研究使用的是MS2Probehandle测定非标准形状的血清瓶,故测得的数值并非瓶中矿化产物的磁化率准确值,但它仍能较好地反映产物磁化率的相对变化.图 1g中20℃组在76h时磁化率仍表现上升趋势,可能表明磁铁矿还在继续生成.其他矿化组磁化率在达到一个最大值后随即开始缓慢下降.由于各个矿化体系后期的理化参数基本保持不变,而且磁铁矿形成后一般很难被细菌进一步还原,推测磁化率的减小可能是磁铁矿形成后粒径逐渐增大导致,这与低温磁学测量反映的粒径增大相符.当较小的SP 磁铁矿体积增大到SD 范围时,磁化率会显著降低.另外,在还原的环境下部分磁铁矿有可能转化为菱铁矿[21].与需要取样测定理化参数的方法相比,磁化率测定能够在不扰动矿化培养体系的情况下灵敏检测反应产物中磁铁矿的形成,因此它是一种简单快速经济的研究细菌体系下磁性矿物矿化的手段[21].室温磁滞回线表明,不同温度下的矿化产物磁铁矿均为SP磁铁矿.磁铁矿的Ms 随培养温度升高而增加,表明温度升高在加快磁铁矿形成速率的同时,也促进了磁铁矿的产量.Roh对分离自热泉附近的耐冷型铁还原细菌Shewanella.sp. PV-4 进行了4℃到37℃的矿化实验,也发现磁铁矿粒径随着温度升高而增大,在18-37℃之间能生成单畴颗粒磁铁矿[22].虽然本实验中 CN32矿化生成的磁铁矿粒度存在随着温度升高而增大的相同趋势,但是在37℃矿化组中没有观察到较大的单畴颗粒磁铁矿,原因有待进一步研究.
铁还原细菌广泛分布在海洋和淡水沉积物中,在厌氧的环境下能够进行铁还原和体外诱导矿化,而且生成的矿物量远较趋磁细菌的磁小体磁铁矿多,而作为矿化反应底物的HFO 在自然界也是普遍存在的,因而铁还原细菌诱导矿化形成的SP 磁铁矿对土壤和沉积物磁化率的贡献是不可忽略的[23-26].另外,相比于大多数无法在37℃下存活的海洋Shewanella[27],S.putrefaciens CN32 在4-50℃之间能够形成磁铁矿的现象,暗示了中温型铁还原菌矿化温度范围的广泛性以及该类细菌在自然环境中磁铁矿矿化的重要性要高于原先估计.在铁还原细菌的生物矿化过程中,除了温度以外,其他环境因子如压力、pH 值、培养基组分,以及细菌种类等都能影响矿化过程和矿化产物,它们对矿化过程及产物的影响仍有待进一步研究.
5 结语铁还原细菌S.putrefaciens CN32 在中温条件下(20-37℃)能够还原HFO,生成结晶较好的SP磁铁矿颗粒(平均直径约11nm).实验体系的理化参数和磁化率的变化表明,培养温度的升高可能在矿物沉淀的热力学和生物活性两方面加快了矿化反应的进行.实验发现,AQDS 作为电子传递体加速了铁还原,可能增强了厌氧条件下的细菌代谢,使体系更加偏向还原和碱性条件,更有利于磁铁矿的快速形成.矫顽力值和阻挡温度Tb 的增大都表明产物磁铁矿的粒径随着细菌培养温度的升高而增大.
| [1] | Harrison R J, Feinberg J M. Mineral Magnetism: Providing new insights into Geoscience processes. Elements , 2009, 5(4): 209-215. DOI:10.2113/gselements.5.4.209 |
| [2] | Dunlop D J. Superparamagnetic and single-domain threshold sizes in magnetite. J. Geophys. Res. , 1973, 78(11): 1780-1793. |
| [3] | Zhou L P, Oldfield F, Wintle A G, et al. Partly pedogenic origin of magnetic variations in Chinese loess. Nature , 1990, 346(6286): 737-739. DOI:10.1038/346737a0 |
| [4] | Frankel R B. Anaerobes pumping iron. Nature , 1987, 330(6145): 208-208. DOI:10.1038/330208a0 |
| [5] | Lovley D R. Dissimilatory Fe (Ⅲ) and Mn (Ⅳ) reduction. Microbiological Reviews , 1991, 55(2): 259-287. |
| [6] | Lovley D R, Stolz J F, Nord G L, et al. Anaerobic production of magnetite by a dissimilatory iron-reducing microorganism. Nature , 1987, 330(6145): 252-254. DOI:10.1038/330252a0 |
| [7] | Myers C R, Nealson K H. Microbial reduction of manganese oxides: Interactions with iron and sulfur. Geochimica et Cosmochimica Acta , 1988, 52(11): 2727-2732. DOI:10.1016/0016-7037(88)90041-5 |
| [8] | Fredrickson J K, Zachara J M, Kennedy D W, et al. Biogenic iron mineralization accompanying the dissimilatory reduction of hydrous ferric oxide by a groundwater bacterium. Geochimica et Cosmochimica Acta , 1998, 62(19-20): 3239-3257. DOI:10.1016/S0016-7037(98)00243-9 |
| [9] | Lee J H, Roh Y, Hur H G. Microbial production and characterization of superparamagnetic magnetite nanoparticles by Shewanella sp HN-41. Journal of Microbiology and Biotechnology , 2008, 18(9): 1572-1577. |
| [10] | Kappler A, Straub K L. Geomicrobiological cycling of iron. Molecular Geomicrobiology , 2005, 59(1): 85-108. |
| [11] | Lovley D R, Coates J D, Blunt-Harris E L, et al. Humic substances as electron acceptors for microbial respiration. Nature , 1996, 382(6590): 445-448. DOI:10.1038/382445a0 |
| [12] | Kato C, Nogi Y. Correlation between phylogenetic structure and function: examples from deep-sea Shewanella. FEMS Microbiology Ecology , 2001, 35(3): 223-230. DOI:10.1111/fem.2001.35.issue-3 |
| [13] | Stookey L L. Ferrozine-a new spectrophotometric reagent for iron. Analytical Chemistry , 1970, 42(7): 779-781. DOI:10.1021/ac60289a016 |
| [14] | Vali H, Weiss B, Li Y L, et al. Formation of tabular single-domain magnetite induced by Geobacter metallireducens GS-15. Proceedings of the National Academy of Science , 2004, 101(46): 16121-16126. DOI:10.1073/pnas.0404040101 |
| [15] | Zhang C L, Vali H, Romanek C S, et al. Formation of single-domain magnetite by a thermophilic bacterium. American Mineralogist , 1998, 83: 1409-1418. DOI:10.2138/am-1998-11-1230 |
| [16] | Zachara J M, Kukkadapu R K, Fredrickson J K, et al. Biomineralization of poorly crystalline Fe (Ⅲ) oxides by dissimilatory metal reducing bacteria (DMRB). Geomicrobiology Journal , 2002, 19(2): 179-207. DOI:10.1080/01490450252864271 |
| [17] | Wang F P, Wang P, Chen M X, et al. Isolation of extremophiles with the detection and retrieval of Shewanella strains in deep-sea sediments from the west Pacific. Extremophiles , 2004, 8(2): 165-168. DOI:10.1007/s00792-003-0365-0 |
| [18] | Lovley D R, Fraga J L, Blunt-Harris E L, et al. Humic substances as a mediator for microbially catalyzed metal reduction. Acta Hydrochimica et Hydrobiologica , 1998, 26(3): 152-157. DOI:10.1002/(ISSN)1521-401X |
| [19] | Hansel C M, Benner S G, Neiss J, et al. Secondary mineralization pathways induced by dissimilatory iron reduction of ferrihydrite under advective flow. Geochimica et Cosmochimica Acta , 2003, 67(16): 2977-2992. DOI:10.1016/S0016-7037(03)00276-X |
| [20] | Dunlop D J, O″zdemir O″. Rock Magnetism: Fundamentals and Frontiers. New York: Cambridge University Press, 1997 . |
| [21] | Porsch K, Dippon U, Rijal M L, et al. In-situ magnetic susceptibility measurements as a tool to follow geomicrobiological transformation of Fe minerals. Environmental Science & Technology , 2010, 44(10): 3846-3852. |
| [22] | Roh Y, Gao H C, Vali H, et al. Metal reduction and iron biomineralization by a psychrotolerant Fe (Ⅲ)-reducing bacterium, Shewanella sp. strain PV-4.. Applied and Environmental Microbiology , 2006, 72(5): 3236-3244. DOI:10.1128/AEM.72.5.3236-3244.2006 |
| [23] | Hanesch M, Petersen N. Magnetic properties of a recent parabrown-earth from Southern Germany. Earth and Planetary Science Letters , 1999, 169(1-2): 85-97. DOI:10.1016/S0012-821X(99)00076-X |
| [24] | Dearing J A, Hannam J A, Anderson A S, et al. Magnetic, geochemical and DNA properties of highly magnetic soils in England. Geophysical Journal International , 2001, 144(1): 183-196. DOI:10.1046/j.0956-540X.2000.01312.x |
| [25] | Guyodo Y, LaPara T M, Anschutz A J, et al. Rock magnetic, chemical and bacterial community analysis of a modern soil from Nebraska. Earth and Planetary Science Letters , 2006, 251(1-2): 168-178. DOI:10.1016/j.epsl.2006.09.005 |
| [26] | Gibbs-Eggar Z, Jude B, Dominik J, et al. Possible evidence for dissimilatory bacterial magnetite dominating the magnetic properties of recent lake sediments. Earth and Planetary Science Letters , 1999, 168(1-2): 1-6. DOI:10.1016/S0012-821X(99)00054-0 |
| [27] | Stapleton R D Jr, Sabree Z L, Palumbo A V, et al. Metal reduction at cold temperatures by Shewanella isolates from various marine environments. Aquatic Microbial Ecology , 2005, 38(1): 81-91. |
 2011, Vol. 54
2011, Vol. 54


