2. 中国科学院研究生院, 北京 100049;
3. 中法生物矿化与纳米结构联合实验室, 北京 100029;
4. 中国科学院地质与地球物理研究所岩石圈演化国家重点实验室, 北京 100029
2. Graduate University of Chinese Academy of Sciences, Beijing 100049, China;
3. Franco-Chinese Biomineralization and Nano-structures Laboratory, Beijing 100029, China;
4. State Key Laboratory of Lithospheric Evolution, Institute of Geology and Geophysics, Chinese Academy of Sciences, Beijing 100029, China
纳米级单畴(SD)磁铁矿颗粒的磁性强而稳定,是地质样品剩磁记录的最佳载体,它们的保存状态直接影响着岩石和沉积物剩磁记录的可靠性.有机质对磁铁矿颗粒保存的影响一直备受关注.已有研究表明,随着有机质含量的增加,有机质氧化降解驱动的磁铁矿颗粒溶解作用明显增强[1, 2].已发现南极半岛西部太平洋陆隆晚中新世-早上新世沉积物中的磁性减弱与有机质的改造有关[3].Hunt等[4]在研究古土壤的磁化率随温度变化时注意到有机质在加热过程中的还原作用;有机质的还原可能导致了全新世黄土加热后磁化率的增加[5].Hanesch等[6]通过对有机质与合成或天然样品的混合物的热磁分析发现,即使在空气环境中加热,有机质也可以将水铁矿、针铁矿或赤铁矿等还原为磁铁矿/磁赤铁矿,导致样品磁化率增强.有机质对SD磁铁矿颗粒稳定性究竟有多大影响,尚缺乏研究.
趋磁细菌(magnetotactic bacteria)是一类能够在地磁场或者外加磁场中定向游弋的原核生物,它能够在体内控制合成链状排列的、有生物膜包被的纳米级磁铁矿(或胶黄铁矿)颗粒.这些纳米级磁颗粒被称为磁小体(magnetosome),其颗粒大小为30~120 nm,晶形完好,化学纯度高,粒度分布窄,多属于稳定单畴颗粒[7, 8].趋磁细菌死亡后形成的化石磁小体(magnetofossil)是部分湖泊和海洋沉积物磁性的重要载体[9, 10].针对在加热过程中有机质对纳米级磁铁矿热稳定性的影响,本文以趋磁细菌AMB-1全细胞和纯化磁小体为研究对象,以热磁分析为主,结合室温磁滞回线和一阶反转曲线(FORC),以及低温磁性测量等,详细研究了纳米级磁铁矿颗粒的热磁学性质.
2 样品准备与实验方法 2.1 样品准备趋磁细菌AMB-1菌种购自ATCC(编号ATCC700264)[11].原始菌种经2轮毛细管磁分离活化后,获得产磁能力强的AMB-1菌株[12].将活化后的AMB-1细胞接种到10 L的磁螺菌生长培养基中,26℃静止培养72 h后,4℃离心收集全细胞.透射电子显微镜(TEM)研究表明,AMB-1在细胞内合成一条片段化的磁小体链,磁小体为立方-八面体磁铁矿,平均尺寸约45 nm,这与我们早期观测结果一致[13, 14].据Frankel等[15]对淡水趋磁细菌的原子吸收光谱分析结果,细胞内的铁约占细胞干重的1.5%,我们估计趋磁细菌AMB-1全细胞中有机质约占95%(重量百分比),有机质成分主要为碳、氢、氧、氮等,此外还有少量的硫(约占细胞总质量的2~3%).
将一半细胞重新悬浮于蒸馏水中,在冰浴中经超声波破碎细胞(功率50 W,破碎5 s,间歇10 s,共30 min).用磁铁吸附分离磁小体,加蒸馏水重悬、洗涤,共重复5次以上得纯化磁小体样品.TEM观测表明,纯化的磁小体被4~6 nm厚的磁小体膜包裹.磁小体膜成分与细胞膜类似,主要是磷脂双分子和蛋白质.根据磁小体的平均粒径和磁小体膜的厚度,以及二者的密度,可估算出纯化磁小体中有机质和磁铁矿颗粒质量比约为1:99.实验中纯化磁小体和全细胞样品经冷冻干燥后,进行磁学测量.
2.2 实验方法磁化率随温度变化曲线(κ-T)在带CS-3温控系统的KLY-3S卡帕桥上完成,仪器灵敏度2.5×10-8 SI.对纯化磁小体样品和全细胞样品分别进行分步加热,升温速率11℃/ min.在氩气环境中将样品逐步加热到最高温度分别为100℃,200℃,300℃,400℃,500℃,600℃和700℃,之后再将逐步加热到700℃后的样品重复2次加热到700℃,测量每次升温和降温的低场κ-T曲线,以观察样品及可能的中间产物的热稳定性.
样品加热前后的室温磁滞回线和FORC图的测量在振荡磁强计(型号VSM-3900)上完成,该仪器的磁场控制精度0.05%,灵敏度5×10-10 Am2.
样品的低温磁学测量在低温磁性测量系统(型号MPMSXP-5)上完成,该仪器的控温精度±0.5%,相对灵敏度5.0×10-11 Am2.样品的FC(field cooling)曲线是在有场(2.5 T)中冷却到10 K,此时样品获得10 K、2.5 T时的饱和等温剩磁(SIRM2.5 T),然后撤去外磁场,在零场中测量样品的饱和剩磁随温度升高的变化曲线(从10 K升到300 K).样品的Verwey转化温度值(Tv)定义为FC曲线的一阶求导最大值所对应的温度.
3 实验结果 3.1 磁化率随温度变化特征 3.1.1 纯化磁小体的分步加热κ-T曲线不同磁性矿物在加热和冷却过程中的磁化率随温度变化特征可以用来识别磁性矿物种类和粒度分布、以及加热过程中的矿物相变化[16~18].纯化磁小体在加热过程中显示出极强的热稳定性,在600℃前的加热曲线和冷却曲线完全可逆(图 1(a-f)).其中400℃前的磁化率基本保持不变(图 1(a-d)),加热到500℃时,磁化率开始显著上升(图 1e),并在约570℃形成窄且高的Hopkinson峰(图 1f),这与纯化磁小体样品中SD磁铁矿粒度分布窄、部分解阻为超顺磁颗粒(SP)后磁化率显著增大有关.当加热到580℃时,样品磁化率陡降至几乎为零(图 1f),这对应了磁铁矿的居里温度.含量很低的磁小体膜(<1 wt%)几乎没有产生影响,进一步证实了SD磁铁矿很强的热稳定性.

|
图 1 趋磁细菌AMB-1纯化磁小体在氩气环境中逐步加热的的曲线κ-T, 其中粗线和细线分别为加热和冷却曲线. (a~g)表示样品以10CTC间隔逐步加热到700℃; (h~i)表示样品经逐步加热后再两次重复加热到700℃ Fig. 1 Stepwise heating κ-T curves of Magnetos pirillurn magneticum AMB-1 isolated magnetosomes in argon atmosphere. Thick and thin lines represent heating and cooling processes, respectively, (a~g) Stepwise heating up to 700℃ at intervals of 100℃; (h~i) Repeated heating up to 700℃ for twice after the stepwise heating processes |
加热到700℃时,冷却曲线Hopkinson峰值有所降低(图 1g),可能是由于少量粒度较小的磁铁矿在加热过程中发生转化,但是我们注意到,冷却曲线磁化率在600℃以上磁化率值几乎为零,580℃左右陡升,进一步表明磁铁矿颗粒热稳定性强,加热到700℃基本未发生变化.
当样品第二次加热到700℃时,κ-T曲线中磁化率630℃之前降为零(图 1h),居里温度上升,表明磁铁矿开始逐渐向磁赤铁矿转化.第三次加热到700℃的κ-T曲线(图 1i),磁化率在约630℃陡降,反映磁铁矿向磁赤铁矿的进一步转化.同时Hopkinson峰上升,这可能与加热过程中磁性颗粒粒度分布的改变有关.
3.1.2 全细胞样品的分步加热κ-T曲线200℃前,样品磁化率随温度未发生明显变化,加热曲线和冷却曲线基本可逆(图 2(a,b)).与纯化磁小体样品不同,当继续向300℃加热时,受到有机质的影响,磁化率在270℃后开始有明显的减小(图 2c),表明全细胞中SD磁铁矿矿物开始发生转化.冷却曲线低于加热曲线,在约150℃又显著上升,高于初始磁化率(图 2c),反映了新生成磁性矿物的信息.
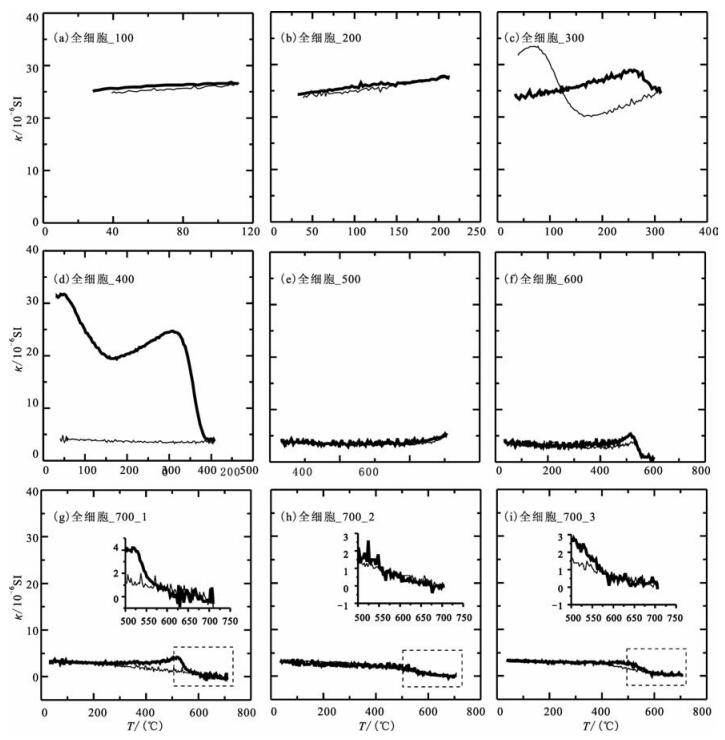
|
图 2 趋磁细菌AMB-1全细胞在氩气环境中逐步加热的的κ-T曲线, 其中粗线和细线分别为加热和冷却曲线. (a~g)表示样品以100℃间隔逐步加热到700℃; (h~i)为样品经逐步加热后再两次重复加热到700℃ Fig. 2 Stepwise heating κ-T curves of Magnetos pirillurn magneticum AMB-1 whole cell in argon atmosphere.Thick and thin lines represent heating and cooling processes, respectively.(a~g) Stepwise heating up to 700℃ at intervals of 100℃; (h~i) Repeated heating up to 700℃ for twice after the stepwise heating processes |
当继续加热到400℃时,κ-T曲线(图 2d)出现更加显著的变化.室温加热至150℃,磁化率迅速减小,之后曲线开始上升,在约320℃达到峰值,320℃~400℃磁化率迅速降至初始值的85%.冷却曲线磁化率保持这一低值,表明细胞中的SD磁铁矿几乎完全转化.后续加热实验,磁化率一直为低值. 580℃磁化率降至几乎为零(图 2f),显示存在少量残存的磁铁矿.重复三次700℃加热,κ-T曲线在520℃的小峰和580℃的降低均变得不明显(图 2(g~i)),反映在加热过程中向弱磁性矿物的进一步转变.
3.2 全细胞样品加热前后的室温和低温磁学性质为了进一步探讨全细胞加热过程中磁铁矿的变化,我们测量了典型样品加热前后的磁滞回线和FORC图,以及低温磁学性质.全细胞样品加热前(图 3a)的磁滞回线呈现Stoner-Wohlfarth型[19].当加热300℃后,样品的矫顽力(Bc)、剩磁矫顽力(Bcr)和剩磁比(Mrs/Ms)由加热前的26.5 mT、34.1 mT和0.45,分别减小到15.2 mT、21.8 mT和0.36,剩磁矫顽力与矫顽力的比(Bcr/Bc)也相应地由1.28增加到1.43(图 3b).以上磁滞参数的变化与加热过程中细胞的有机质分解引起磁小体链坍塌,导致颗粒间的静磁相互作用显著增强有关[13, 20~22].加热到300℃的FORC图纵轴(Hu)展布在低矫顽力区接近10 mT,与加热前(不到5 mT)相比明显变宽,证实了热处理造成磁铁矿颗粒间相互作用的增强.同时,FORC图沿横轴的分布向左移动,与磁滞回线所反映的Bc和Bcr的减小一致.

|
图 3 趋磁细菌AMB-1全细胞样品加热前后的室温磁滞回线(左), 室温FORC图(中), 和低温下的热退磁曲线(右), 其中FORC图平滑因子为2.(a)加热前, (b-d)表示样品分别加热到300℃, 400℃和700℃后. Fig. 3 Room temperature hysteresis Loops (left), FORC diagrams (mid) and low temperature demagnetization curves (right) of Magnetos pirillum magneticum AMB-1 whole cell.(a) Unheated; (b~d) Refers to sample after heating to 300℃, 400℃ and 700℃, respectively. |
在加热到400℃后,全细胞样品呈现顺磁信号为主,其Bc,Bcr和Mrs均进一步显著减小,Bcr/Bc增大(图 3c),说明细胞中大部分SD磁铁矿在加热过程中已经发生转变.经700℃加热后磁滞回线形状呈典型的顺磁特征(图 3d),与κ-T曲线结果一致.经400℃和700℃加热后样品的FORC图没有显示明显的信号,也表明SD磁铁矿在加热过程中几乎完全转化(图 3(c,d)).
全细胞样品在加热到400℃和700℃后,样品在温度为10 K、磁场强度为2.5 T时获得磁化能力显著降低,分别减至未加热样品的1%和0.1%.但是,由于FC曲线是测量剩磁随温度的变化,不受顺磁性物质的影响,所以FC曲线中仍可见Verwey转换信息,这也说明样品中仍含有极少量残存的磁铁矿,而Tv从加热前的104 K升高至118~120 K,这可能与有机质对磁铁矿的还原作用有关.
4 讨论早期研究表明,有机质对磁铁矿颗粒保存的影响很大,富含有机质的深海沉积物中细粒磁铁矿可被溶解,加热时有机质也可将赤铁矿、针铁矿或水铁矿等还原为磁铁矿/磁赤铁矿[1~6].我们的研究表明,纯化的磁小体磁铁矿在氩气环境加热到700℃过程中具有极高的稳定性,而在含有机质较多的全细胞样品加热过程中,磁小体磁铁矿在加热过程中发生了强烈的物理和化学变化,进一步说明有机质对纳米级磁铁矿的改造作用非常大.
我们观测到在氩气环境中纳米级磁铁矿在全细胞样品加热到400℃时其磁化率降至几乎为零,磁滞回线呈典型的顺磁性特征,低温退磁曲线记录的剩磁加热后也显著降低了2个数量级.这些结果一致表明,在有机质含量很高的情况下,纳米磁铁矿颗粒在加热过程中很快地向顺磁性物质转化.与此相反,含有机质极少的纯化磁小体样品,在加热到700℃过程并未发生明显变化.因此,我们认为全细胞样品加热过程中磁铁矿的转化可能与细胞中的有机质还原作用有关.有机质如葡萄糖[6]等,可以提供较强的还原环境.我们还注意到细胞的有机质成分,除碳、氢、氧、氮外,还含有少量的硫、磷等成分.值得特别指出的是,硫也有较强的还原性,推测硫也可能参与了磁小体磁铁矿的改造过程.全细胞样品加热过程中κ-T曲线在270℃下降,这与胶黄铁矿或磁黄铁矿的分解温度一致[23, 24].因为在低温磁测量中没有观测到磁黄铁矿30~35 K的相变[25],我们推测在加热过程中可能磁铁矿转化生成胶黄铁矿相.我们在加热后的试管壁上看到了少量黄色固体附着,带有强烈刺鼻味,推测是加热过程中样品分解产生的硫蒸气冷凝产物,支持转变生成胶黄铁矿的推测.在继续加热中胶黄铁矿发生分解,生成黄铁矿[26].这样,在加热过程中纳米级磁铁矿发生了不可逆变化,磁铁矿可能被还原成胶黄铁矿,之后胶黄铁矿又继续分解,最终几乎全部转化成顺磁性物质黄铁矿.当然,目前我们还不清楚细胞有机质和硫对纳米级磁小体磁铁矿的还原过程和各自的贡献,上述矿物相转变路径也有待于矿物学分析的进一步验证.
此外,在全细胞样品加热到300℃后,磁小体磁铁矿的Tv值由新鲜样品的104 K升高到118 K.磁铁矿Tv值的影响因素较多,对生物成因磁铁矿普遍存在的低Tv值目前尚无定论[27].我们推测,含有机质不同的纯化磁小体和全细胞样品进行热磁实验后Tv值的升高,可能暗示了生物控制矿化形成磁铁矿颗粒低的Tv值源自部分氧化或晶格缺陷,经加热或有机质还原使Tv值升高.
5 结论对趋磁细菌AMB-1的纯化磁小体和含磁小体全细胞的热磁分析、磁滞回线、FORC图以及低温磁学分析表明,纯化磁小体(有机质<1 wt%)在氩气环境中加热具有极强的热稳定性.而对于全细胞样品,其中有机质和硫导致其中的纳米级磁铁矿在约270℃时即开始发生转化,400℃以前几乎完全被还原转变为顺磁性矿物;在转化过程中可能有铁硫化物如胶黄铁矿等中间产物生成.有机质较强的还原作用及其受热分解引起颗粒间磁相互作用的增强,还导致了全细胞样品磁滞参数Bc,Bcr和Mrs/Ms的减小与Bcr/Bc的增加,以及FORC图沿纵轴分布展宽和峰值矫顽力的减小.以上磁学分析结果证明有机质对纳米级磁铁矿的热稳定性具有显著影响.因此,地质热事件可导致富有机质样品中SD磁铁矿颗粒的保存机率大大降低.即使它们在成岩后没有遭受过热事件,这些样品在实验室热处理(岩石磁学、热退磁等)过程中,其中的SD磁铁矿颗粒在400℃可以被完全转变为顺磁性矿物.
致谢刘青松研究员和邓成龙研究员在数据分析中提出了建设性意见,在此表示诚挚的感谢.
| [1] | Yamazaki T, Abdeldayem A L, Ikehara K. Rock-magnetic changes with reduction diagenesis in Japan Sea sediments and preservation of geomagnetic secular variation in inclination during the last 30, 000 years. Earth, Planets and Space , 2003, 55(6): 327-340. DOI:10.1186/BF03351766 |
| [2] | Rao V P, Kessarkar P M, Patil S K, et al. Rock magnetic and geochemical record in a sediment core from the eastern Arabian Sea:Diagenetic and environmental implications during the late Quaternary. Palaeogeography, Palaeoclimatology, Palaeoecology , 2008, 270(1-2): 46-52. DOI:10.1016/j.palaeo.2008.08.011 |
| [3] | Hepp D A, Morz T, Hensen C, et al. A late Miocene-early Pliocene Antarctic deepwater record of repeated iron reduction events. Marine Geology , 2009, 266(1-4): 198-211. DOI:10.1016/j.margeo.2009.08.006 |
| [4] | Hunt C, Banerjee S, Han J, et al. Rock-magnetic proxies of climate change in the loess-palaeosol sequences of the western Loess Plateau of China. Geophysical Journal International , 1995, 123(1): 232-244. DOI:10.1111/gji.1995.123.issue-1 |
| [5] | Deng C L, Zhu R X, Verosub K L, et al. Paleoclimatic significance of the temperature-dependent susceptibility of Holocene loess along a NW-SE transect in the Chinese loess plateau. Geophysical Research Letters , 2000, 27(22): 3715-3718. DOI:10.1029/2000GL008462 |
| [6] | Hanesch M, Stanjek H, Petersen N. Thermomagnetic measurements of soil iron minerals:the role of organic carbon. Geophysical Journal International , 2006, 165(1): 53-61. DOI:10.1111/gji.2006.165.issue-1 |
| [7] | Faivre D, Schüler D. Magnetotactic bacteria and magnetosomes. Chemical Reviews , 2008, 108(11): 4875-4898. DOI:10.1021/cr078258w |
| [8] | Bazylinski D A, Frankel R B. Magnetosome formation in prokaryotes. Nature Reviews Microbiology , 2004, 2(3): 217-230. DOI:10.1038/nrmicro842 |
| [9] | 潘永信, 邓成龙, 刘青松, 等. 趋磁细菌磁小体的生物矿化作用和磁学性质研究进展. 科学通报 , 2004, 49(24): 2563–2568. Pan Y X, Deng C L, Liu Q S, et al. Biomineralization and magnetism of bacterial magnetosomes. Chinese Science Bulletin (in Chinese) , 2004, 49(24): 2563-2568. DOI:10.1360/982004-153 |
| [10] | Kopp R E, Kirschvink J L. The identification and biogeochemical interpretation of fossil magnetotactic bacteria. Earth-Science Reviews , 2008, 86(1-4): 42-61. DOI:10.1016/j.earscirev.2007.08.001 |
| [11] | Matsunaga T, Sakaguchi T, Tadakoro F. Magnetite formation by a magnetic bacterium capable of growing aerobically. Applied Microbiology and Biotechnology , 1991, 35(5): 651-655. |
| [12] | Li J H, Ge X, Zhang X K, et al. Recover vigorous cells of Magnetospirillum magneticum AMB-1 by capillary magnetic separation. Chinese Journal of Oceanology and Limnology , 2010, 28(4): 826-831. DOI:10.1007/s00343-010-9068-4 |
| [13] | 李金华, 潘永信, 刘青松, 等. 趋磁细菌Magnetospirillum magneticum AMB-1全细胞和纯化磁小体的磁学比较研究. 科学通报 , 2010, 55(1): 38–44. Li J H, Pan Y X, Liu Q S, et al. A comparative study of magnetic properties between whole cells and isolated magnetosomes of Magnetospirillum magneticum AMB-1. Chinese Science Bulletin (in Chinese) , 2010, 55(1): 38-44. DOI:10.1007/s11434-009-0333-x |
| [14] | Li J H, Pan Y X, Chen G J, et al. Magnetite magnetosome and fragmental chain formation of Magnetospirillum magneticum AMB-1:transmission electron microscopy and magnetic observations. Geophysical Journal International , 2009, 177(1): 33-42. DOI:10.1111/gji.2009.177.issue-1 |
| [15] | Frankel R B, Blakemore R P, Wolfe R S. Magnetite in Freshwater Magnetotactic Bacteria. Science , 1979, 203(4387): 1355-1356. DOI:10.1126/science.203.4387.1355 |
| [16] | Hrouda F. A technique for the measurement of thermal changes of magnetic susceptibility of weakly magnetic rocks by the CS-2 apparatus and KLY-2 Kappabridge. Geophysical Journal International , 1994, 118(3): 604-612. DOI:10.1111/gji.1994.118.issue-3 |
| [17] | 刘青松, 邓成龙. 磁化率及其环境意义. 地球物理学报 , 2009, 52(4): 1041–1048. Liu Q S, Deng C L. Magnetic susceptibility and its environmental significances. Chinese J. Geophys. (in Chinese) , 2009, 52(4): 1041-1048. |
| [18] | 王磊, 潘永信, 李金华, 等. 黄铁矿热转化矿物相变过程的岩石磁学研究. 中国科学D辑:地球科学 , 2008, 51(8): 1144–115. Wang L, Pan Y X, Li J H, et al. Magnetic properties related to thermal treatment of pyrite. Science in China Series D-Earth Sciences (in Chinese) , 2008, 51(8): 1144-115. DOI:10.1007/s11430-008-0083-7 |
| [19] | Stoner E, Wohlfarth E. A mechanism of magnetic hysteresis in heterogeneous alloys.Philosophical Transactions of the Royal Society of London Series A. Mathematical and Physical Sciences , 1948, 240(826): 599-642. DOI:10.1098/rsta.1948.0007 |
| [20] | Muxworthy A R, Williams W, Virdee D. Effect of magnetostatic interactions on the hysteresis parameters of single-domain and pseudo-single-domain grains. Journal of Geophysical Research-Solid Earth , 2003, 108(B11): 2517-2529. DOI:10.1029/2003JB002588 |
| [21] | Muxworthy A R, King J G, Odling N. Magnetic hysteresis properties of interacting and noninteracting micron-sized magnetite produced by electron beam lithography. Geochem Geophys Geosyst , 2006, 7: Q07009. |
| [22] | Kopp R E, Weiss B P, Maloof A C, et al. Chains, clumps, and strings:Magnetofossil taphonomy with ferromagnetic resonance spectroscopy. Earth and Planetary Science Letters , 2006, 247(1-2): 10-25. DOI:10.1016/j.epsl.2006.05.001 |
| [23] | Skinner B J, Erd R C, Grimaldi F S. Greigite, the thio-spinel of iron; a new mineral. American Mineralogist , 1964, 49: 543-555. |
| [24] | Roberts A P. Magnetic properties of sedimentary greigite (Fe3S4). Earth and Planetary Science Letters , 1995, 134(3-4): 227-236. DOI:10.1016/0012-821X(95)00131-U |
| [25] | Torii M, Fukuma K, Horng C S, et al. Magnetic discrimination of pyrrhotite-and greigite-bearing sediment samples. Geophysical Research Letters , 1996, 23(14): 1813-1816. DOI:10.1029/96GL01626 |
| [26] | Krs M, Krsová M, Pruner P, et al. A petromagnetic study of Miocene rocks bearing micro-organic material and the magnetic mineral greigite (Sokolov and Cheb basins, Czechoslovakia). Physics of the Earth and Planetary Interiors , 1990, 63(1-2): 98-112. DOI:10.1016/0031-9201(90)90064-5 |
| [27] | Pan Y X, Petersen N, Winklhofer M, et al. Rock magnetic properties of uncultured magnetotactic bacteria. Earth and Planetary Science Letters , 2005, 237(3-4): 311-325. DOI:10.1016/j.epsl.2005.06.029 |
 2010, Vol. 53
2010, Vol. 53


